Uppföljning av processerna för introduktion av nya läkemedel i Sverige
Mellan 30 och 60 helt nya läkemedel introduceras varje år i Sverige. Det finns en stor variation mellan läkemedlen avseende användningsområde, ytterligare tillförd nytta och förväntad användning. Processerna för att introducera och prioritera läkemedel behöver kunna hantera dessa olika typer av läkemedel. Sedan ett par år tillbaka utvecklas processerna i Sverige av flera organisationer och utifrån olika målsättningar.
LIF har under år 2015 och 2016 arbetat med att ta fram mått för hur processernas effektivitet och måluppfyllelse förändras över tid. Ambitionen är att kunna besvara tre centrala frågor:
- Hur effektiva är prioriteringsprocesserna för nya läkemedel?
- Hur jämnt introduceras nya, unika läkemedel i olika delar av landet?
- Hur mycket varierar användningen av nyintroducerade läkemedel i olika delar av landet?
Uppföljningen finns att ladda ner som Power point-presentation eller som pdf.
Baserat på uppföljningen för helåret 2016 drar vi följande sammanfattande slutsatser:
- TLV:s och NT-rådets hantering är snabbare för det mindre antal läkemedel som valts ut för att hanteras i de nya nationella processerna - men arbetssättet är administrativt krävande och det tycks saknas tillräckliga resurser för att hantera det stora inflödet av nya läkemedel och nya indikationer.
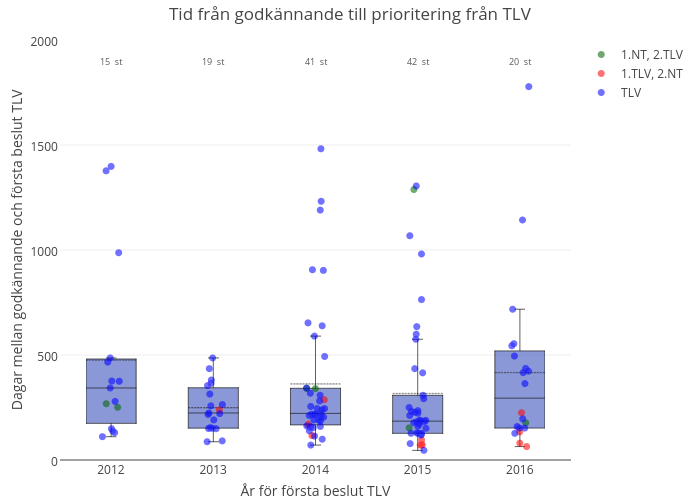
För många läkemedel tar det mer än ett år innan ett första subventionsbeslut fattas. Under 2016 fattade TLV betydligt färre subventionsbeslut för nya läkemedel jämfört med tidigare år. Trots det ökade den genomsnittliga tiden till första subventionsbeslut. Det kan ha flera orsaker - att läkemedelsföretagen avvaktar med att ansöka om förmån i Sverige, längre handläggningstid, fler s.k. clock-stops, fler tillbakadragna ansökningar och att trepartsöverläggningar under 2016 även har använts för att hantera biosimilarkonkurrens för äldre läkemedel (TNF-hämmare). I samband med implementeringen av Landstingens samverkansmodell under 2015 utfärdade NT-rådet rekommendationerna för klinikläkemedel väsentligt mycket snabbare än tidigare. Under år 2016 har endast ett fåtal nya klinikläkemedel prioriterats av NT-rådet, som istället har valt att hantera tidigare ingångna avtal och nya indikationer. - Användningen av nya unika cancerläkemedel tycks etableras mer jämnt i sjukvårdsregionerna under senare år - men skillnaden mellan olika läkemedel och uppföljningstidens längd gör det svårt att redan nu dra slutsatsen att de nya processerna leder till en jämnare introduktion i landet.
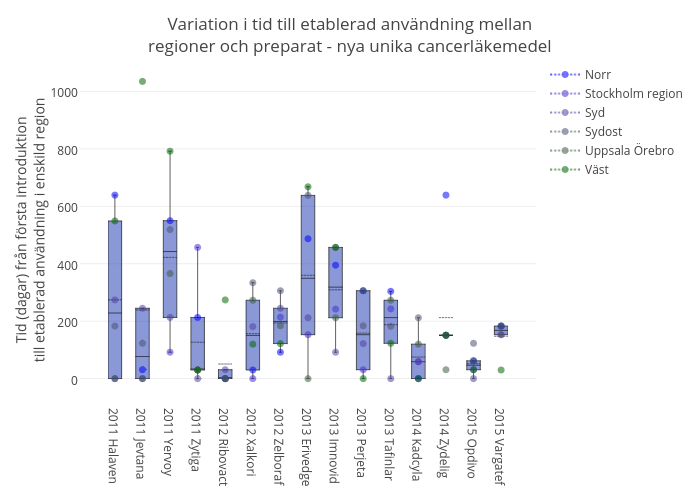
Under det tidiga 10-talet kunde det ta upp emot två år innan användningen av ett nytt unikt cancerläkemedel etablerats i alla sjukvårdsregioner. Under 2014 och 2015 var skillnaden i tid cirka ett år. I analysen har en ökad användning under ett halvår använts som definition för att användning etablerats. Den uppmätta tidsskillnaden mellan regioner kan därmed komma att öka med längre uppföljningstid, i takt med att fler läkemedel nått etablerad användning i alla sjukvårdsregioner. - Ingen region lägger genomgående mer eller mindre resurser på nya unika läkemedel jämfört med övriga – men enskilda regioner förefaller prioritera olika mellan terapiområden trots en ambition om en mer jämlik och nationell hantering.
För att fånga eventuella systematiska skillnader i hur mycket resurser enskilda regioner lägger på nya, unika läkemedel - som har introducerats vid olika tidpunkter under år 2011 till 2016 – har läkemedlen grupperats inom terapiområden. Det finns flera terapiområden där den regionala variationen i vilka resurser som läggs på nya unika läkemedel är mycket liten, men inom vissa terapiområden skiljer sig resursanvändningen åt med mer än 50 procent mellan vissa regioner. Det tyder på att det fortfarande sker många lokala prioriteringar som påverkar patienters tillgång till behandling. Läkemedel för behandling av hepatit C har varit den huvudsakliga piloten för det nya sättet att introduceras läkemedel. Här har även särskild finansiering skjutits till från staten. Kombinationen av effektiva processer och tydlig finansiering förefaller effektiv eftersom det är ett av terapiområdena som uppvisar minst variation i resursanvändning mellan sjukvårdsregionerna.
Se nedan för de analyser som de sammanfattande slutsatserna ovan baseras på. För metodbeskrivning för figurerna, se följande länk.
En presentation med dessa och vissa ytterligare bilder kan laddas ner här.
Tabell 1: Prioritering av nyintroducerade läkemedel (2014-2016), försäljning 2016 (mnkr) & antal produkter.
Figur 1. Nyintroducerade läkemedel i Sverige. Tid från marknadsföringsgodkännande till första subventionsbeslut från TLV. Röd markering: Läkemedel som efter positivt subventionsbeslut får NT-rekommendation. Grön markering: Läkemedel som innan positivt subventionsbeslut får NT-rekommendation (ej avvakta/vänta rekommendation).
Sammanfattande tabell för figur 1 finner du här.
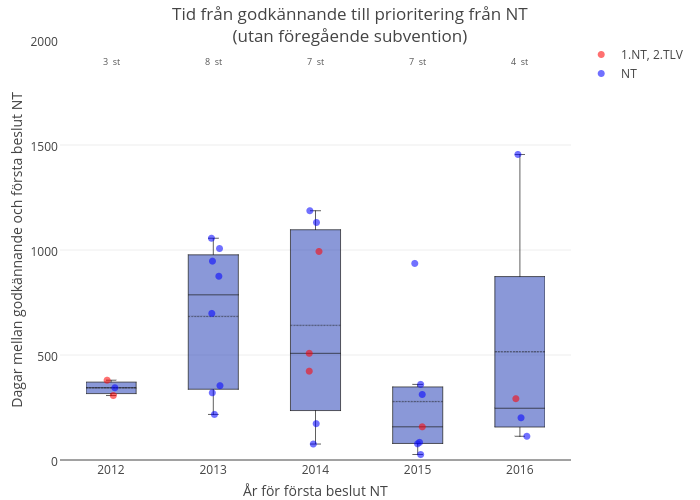
Figur 2. Nyintroducerade läkemedel i Sverige. Tid från marknadsföringsgodkännande till första prioriteringsbeslut från NT-rådet. Rekommendationer för redan subventionerade läkemedel samt avvakta-rekommendationer inte inkluderade. Röd markering: Läkemedel som också fått TLV beslut.
Sammanfattande tabell för figur 2 finner du här.
Figur 3. Nyintroducerade läkemedel mot cancer. Tid från första användning i Sverige till etablerad användning i enskilda sjukvårdsregioner. Endast första läkemedlet i varje klass inkluderad. Endast läkemedel som etablerats i alla regioner, som inte är särläkemedel och vars användningsområde bedöms vara jämnt fördelat i Sverige har inkluderats.
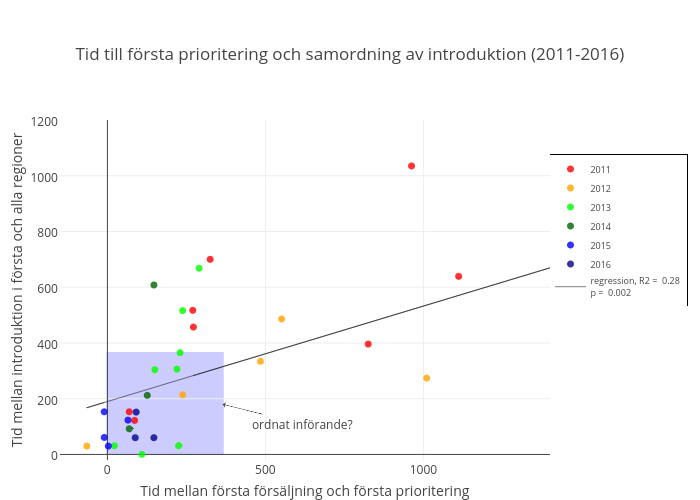
Figur 4. Nyintroducerade, unika läkemedel. Tid från etablerad användning i första sjukvårdsregion till etablerad användning i alla regioner samt tid mellan första försäljning i Sverige till första nationella prioritering (ej avvakta-rekommendationer från NT inkluderade). Endast läkemedel som etablerats i alla regioner, som inte är särläkemedel, smittskyddsläkemedel, vaccin eller p-piller och vars användningsområde bedöms vara jämnt fördelat i Sverige är inkluderade. Blå rektangel indikerar etablerad användning i alla regioner samt nationell prioritering inom ett år. Färgmarkering indikerar introduktionsår för enskilt läkemedel. Figuren har flera felkällor, bland annat observationsbias avseende tid från introduktion. Figuren ska framförallt ses som en principbild för vad som kan anses vara ordnat införande av ett läkemedel, samt vilka läkemedel som då kan sägas ha introducerats på ett geografiskt ordnat sätt.
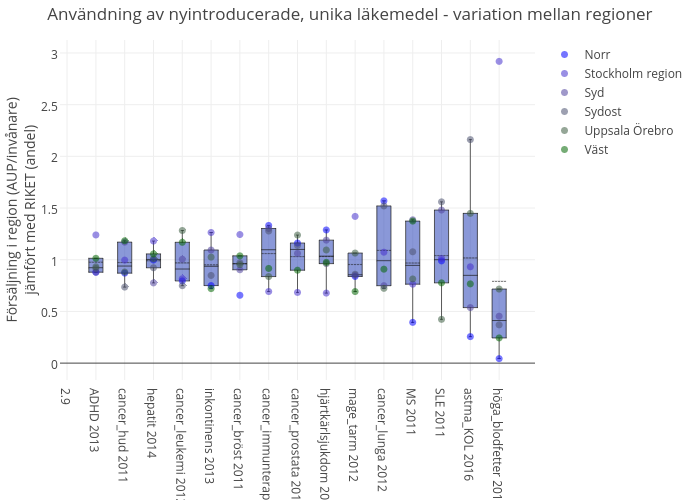
Figur 5. Nyintroducerade, unika läkemedel. Sammanräknad resursåtgång för olika terapiområden (AUP per invånare) i enskilda sjukvårdsregioner relativt riksgenomsnittet. Årtalet anger år för introduktion för första läkemedel som inkluderats i gruppen. Endast läkemedel som inte är särläkemedel, smittskyddsläkemedel, vaccin eller p-piller och vars användningsområde bedöms vara jämnt fördelat i Sverige är inkluderade. Figuren har flera felkällor, bland annat kan den beräknade resursåtgången påverkas av mindre variationer i pris för enskilda rekvisitionsläkemedel mellan landsting.