Öppen rapportering av värdeöverföringar
EFPIA* antog 2013 en ny etisk uppförandekod som innebär att värdeöverföringar i form av exempelvis konsultarvoden från läkemedelsföretag till hälso- och sjukvårdspersonal eller övrig hälso- och sjukvård kommer att göras publika. Detta initiativ gäller hela Europa och därmed även Sverige. Läkemedelsföretag** som agerar på den svenska marknaden kommer därför att publicera vilka personer eller organisationer i Sverige som har fått värdeöverföringar under ett visst år, samt det sammanlagda värdet av dessa. Rapporteringen sker årsvis av företagen och där den första rapporteringen skedde 2016, baserat på utbetalningar som skett under 2015.
Varför tar läkemedelsbranschen frivilligt detta initiativ?
Uppförandekoden har kommit till mot bakgrund av de ökande förväntningarna från omvärlden att samspelet mellan företag och samhälle är transparent.
En målsättning för branschen är att öka omvärldens förståelse för de viktiga samarbeten som sker mellan läkemedelsföretag och hälso- och sjukvårdens organisationer och medarbetare.
För Lif har öppenhet och transparens länge varit ledord. Lif startade t.ex. redan 2004 Lifs Samarbetsdatabas värdeöverföringar och Samarbetsdatabas som bland annat öppet visar vilka samarbeten som finns mellan läkemedelsföretag och patientorganisationer men som senare utvidgats till att omfatta även samarbeten med hälso- och sjukvården.
Vilka uppgifter kring värdeöverföringar ska göras offentliga?
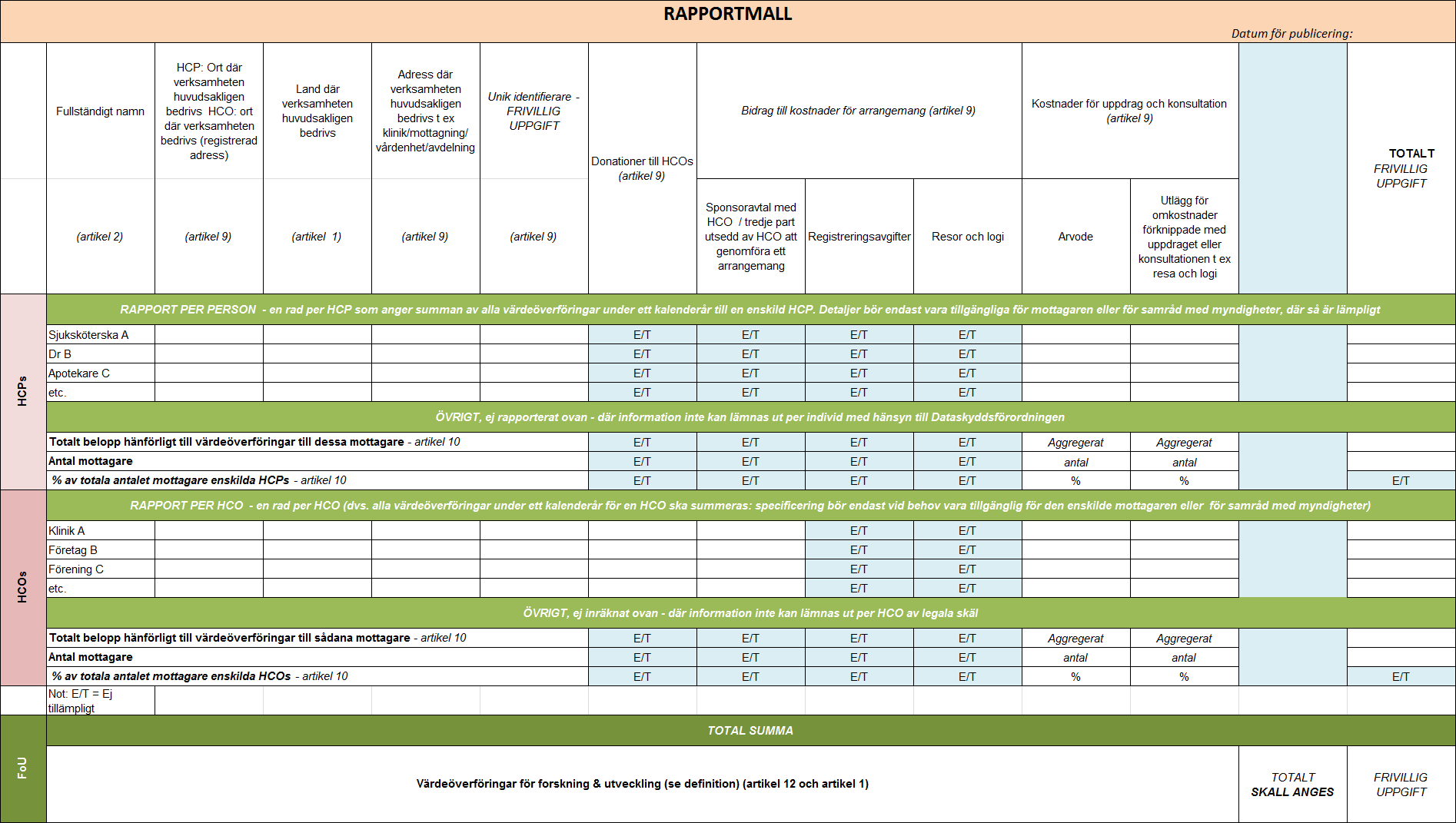
För hälso- och sjukvårdspersonal (HCP)
- Namn och adress där personen huvudsakligen är verksam
- Konsultarvoden
- Utlägg för omkostnader vid uppdrag (t.ex. resa och logi)
För hälso- och sjukvård (HCO)
- Namn (t.ex. på sjukhus, klinik, företag, förening etc.) och adress där organisationen huvudsakligen bedriver sin verksamhet
- Donationer
- Bidrag till kostnader för arrangemang (t.ex. sponsringskostnader)
- Konsultarvoden
- Utlägg för omkostnader vid uppdrag (t.ex. resa och logi)
Har det skett värdeöverföringar vid flera tillfällen under året ska dessa läggas ihop till en totalsumma för respektive HCP och HCO ovan.
För forskning och utveckling
Värdeöverföringar som skett till mottagare i samband med planering eller utförande av studier, eller kliniska prövningar, ska inte specificeras utan rapporteras som en enda totalsumma per år och företag.
Vad ska inte rapporteras?
Förtäring, t.ex. lunch och middag i samband med sammankomster, behöver inte rapporteras. Inte heller måste s.k. informations- och utbildningsmaterial eller hjälpmedel som utdelats rapporteras. Konferensavgifter samt resor och logi i samband med konferenser är inte relevant för Sverige då det från och med den 1 jan 2015 inte längre är tillåtet för läkemedelsföretag att delfinansiera detta.
Hur och var kommer informationen hittas?
Varje läkemedelsföretag använder en särskild rapportmall (se bild) som fylls i och publiceras som t.ex. en pdf-fil senast ett halvår efter det att rapporteringsåret är slut. Alla företags filer hittas samlade på en särskild portal i Lifs s.k. Samarbetsdatabas. Filerna kan också komma att ligga på enskilda företags hemsidor som ett komplement. Samma rapportmall används i hela Europa men oberoende av var i världen en medarbetare i svenska hälso- och sjukvården gör ett konsultuppdrag åt ett läkemedelsföretag, så skall det redovisas i Sverige såvida det är i Sverige medarbetaren normalt bedriver sin huvudsakliga verksamhet.
Med hälso- och sjukvårdspersonal (HCP) avses läkare, tandläkare, farmacevt, sjuksköterska eller annan personal inom hälso- och sjukvården som har rätt att förskriva, köpa, tillhandahålla, rekommendera eller administrera läkemedel, inklusive anställd hos läkemedelsföretag vars huvudsakliga sysselsättning är inom hälso- och sjukvården. Övriga anställda hos läkemedelsföretag eller läkemedelsdistributör omfattas inte av begreppet hälso- och sjukvårdspersonal.
Med hälso- och sjukvård (HCO) avses varje juridisk person som bedriver hälso- och sjukvård eller forskning eller undervisning inom detta område, eller är en intresseorganisation med medicinsk eller vetenskaplig inriktning, med undantag för intresseorganisation som avses i LER Kapitel 3.
Med värdeöverföring för forskning och utveckling avses värdeöverföring till mottagare i samband med planering eller utförande av (i) icke-klinisk studie (definierad i OECD:s principer för god laboratoriesed), (ii) klinisk prövning eller (iii) icke-interventionsstudie som omfattar insamling av patientdata från hälso- och sjukvårdspersonal eller för deras räkning.
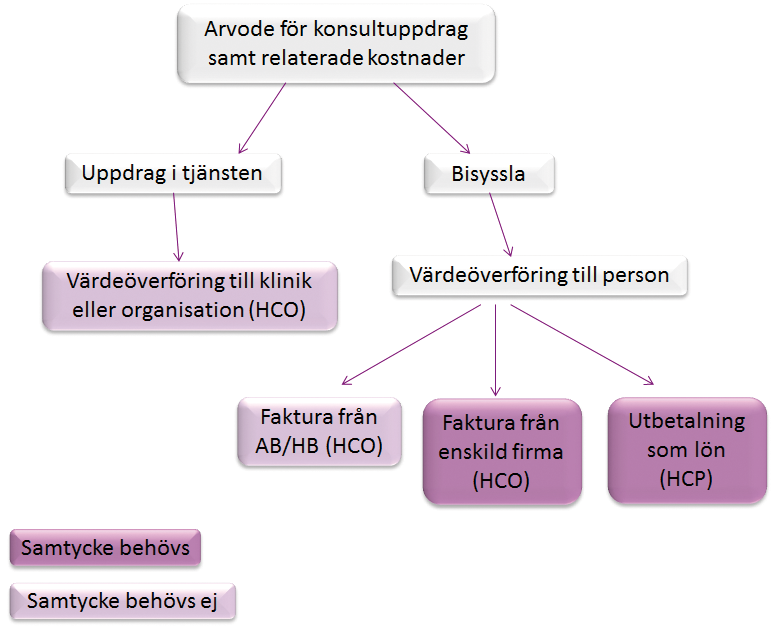
Om dataskyddsförordningen (GDPR) och samtycke till publicering
Om läkemedelsföretaget använder samtycke från hälso- och sjukvårdspersonalen (t.ex. en konsult) som rättslig grund för publicering av en värdeöverföring, ska samtycket ges via skriftligt avtal. Det är av yttersta vikt att medarbetare samtycker till publicering av uppgifterna för att transparens ska uppnås.
För hälso- och sjukvård i form av sjukhus, kliniker, organisationer, aktiebolag eller handelsbolag så krävs inget samtycke innan publicering sker. Se beslutsträdet här intill.
Översikt över kravet på samtycke vid konsultuppdrag
** Läkemedelsföretag anslutna till Lif – de forskande läkemedelsföretagen, FGL – Föreningen för Generiska Läkemedel eller IML, Innovativa Mindre Life-science-företag samt EFPIA.
